Poradenství Nová pravidla EU pro léčivé přípravky: Jaké výhody z nich mohou výrobci získat
Dne 26. dubna 2023 přijala Evropská komise návrh nové směrnice a nového nařízení, které revidují a nahrazují stávající obecné farmaceutické právní předpisy. Konkrétně se jedná o návrh Komise na směrnici o léčivých přípravcích (nahrazuje směrnici 2001/83/ES) a návrh Komise na nařízení o léčivých přípravcích (nahrazuje nařízení 726/2004). V čem navrhované změny spočívají a jaké strategické příležitosti z nich pro podniky působící ve farmaceutickém průmyslu vyplývají?
Směrnice obsahuje veškerá pravidla pro registraci, dozor, označování a právní ochranu, uvádění na trh a další postupy pro všechny léčivé přípravky registrované na úrovni EU a na vnitrostátní úrovni.
Nařízení obsahuje (kromě směrnice) zvláštní ustanovení pro léčivé přípravky registrované na úrovni EU (zejména pro nejinovativnější z nich), které zavádí pravidla pro koordinované řízení kritických nedostatků a zabezpečení dodávek kritických léčivých přípravků. Upravuje rovněž činnost Evropské agentury pro léčivé přípravky (EMA).
Od svého zveřejnění byly tyto návrhy předmětem kontroverzních diskusí a připomínek zúčastněných stran působících v odvětví zdravotní péče. V centru pozornosti je zejména navrhované podmíněné prodloužení ochranné lhůty léčivých přípravků (resp. zkrácení zaručené ochranné lhůty). Je to pochopitelné, protože se jedná o potenciál prodeje, který může podle Komise u chráněného přípravku činit v průměru 500 milionů eur ročně. Stojí proto za to podívat se blíže na podrobnosti navrhované úpravy ochrany dokumentů a na to, jaké strategické příležitosti z ní pro podniky působící ve farmaceutickém průmyslu vyplývají.
Kontext
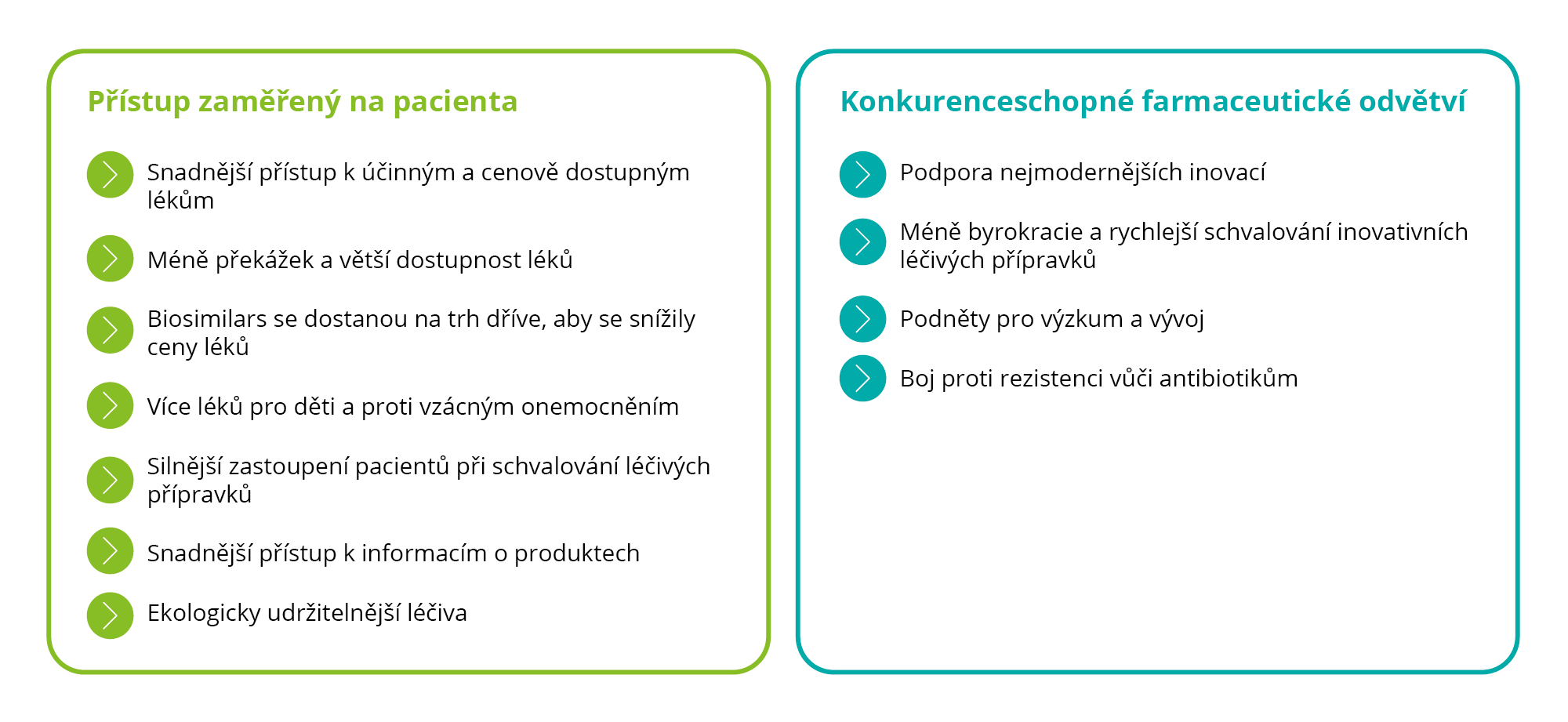
V listopadu 2020 přijala Komise strategii pro léčivé přípravky v Evropě. Poprvé formulovala požadavek na sladění priorit výzkumu v průmyslu s potřebami pacientů a požadavky systémů zdravotní péče.
Obrázek 1: Cíle strategie pro léčivé přípravky pro Evropu
„Jedná se o strategii zaměřenou na pacienty, jejímž cílem je zajistit kvalitu a bezpečnost léčivých přípravků a zároveň zvýšit globální konkurenceschopnost tohoto odvětví. Tvoří podpůrný pilíř vize Komise pro budování silnější Evropské zdravotnické unie […].“
(Ursula von der Leyenová, předsedkyně Evropské komise, projev o stavu Unie 2020)
Již ve strategii pro léčivé přípravky pro Evropu jsou uvedeny velmi konkrétní myšlenky, jak v budoucnu motivovat k inovacím, mj.:
- „[…]Navrhnout revizi systému pobídek a povinností vyplývajících z farmaceutických právních předpisů, s přihlédnutím k propojení s právy duševního vlastnictví, s cílem podpořit inovace, přístup a cenovou dostupnost léčiv v celé EU […].“
- „[…]To může rovněž znamenat silnější „podmíněnost“, tj. propojení pobídek s podporou širšího přístupu pro pacienty a možností zvýšit konkurenci […].“
V nyní předkládaných legislativních návrzích ze dne 26. dubna 2023 jsou tyto myšlenky převzaty a dále specifikovány z hlediska nových požadavků na farmaceutické společnosti založené na výzkumu.
Koncept „podmíněné exkluzivity“ pro léčivé přípravky v Evropě
Evropská komise formulovala řadu cílů reformy farmaceutického odvětví.
Obrázek 2: Cíle nového legislativního procesu EU5
Klíčovým mechanismem pro dosažení těchto cílů je navrhovaná reforma režimu ochranných lhůt pro patentově chráněné inovativní léčivé přípravky. V předchozím režimu byla ochranná lhůta chápána jako všeobecný motivační nástroj, který odměňoval vývoj nových léčiv prostřednictvím záruky desetiletého výhradního uvádění na trh.
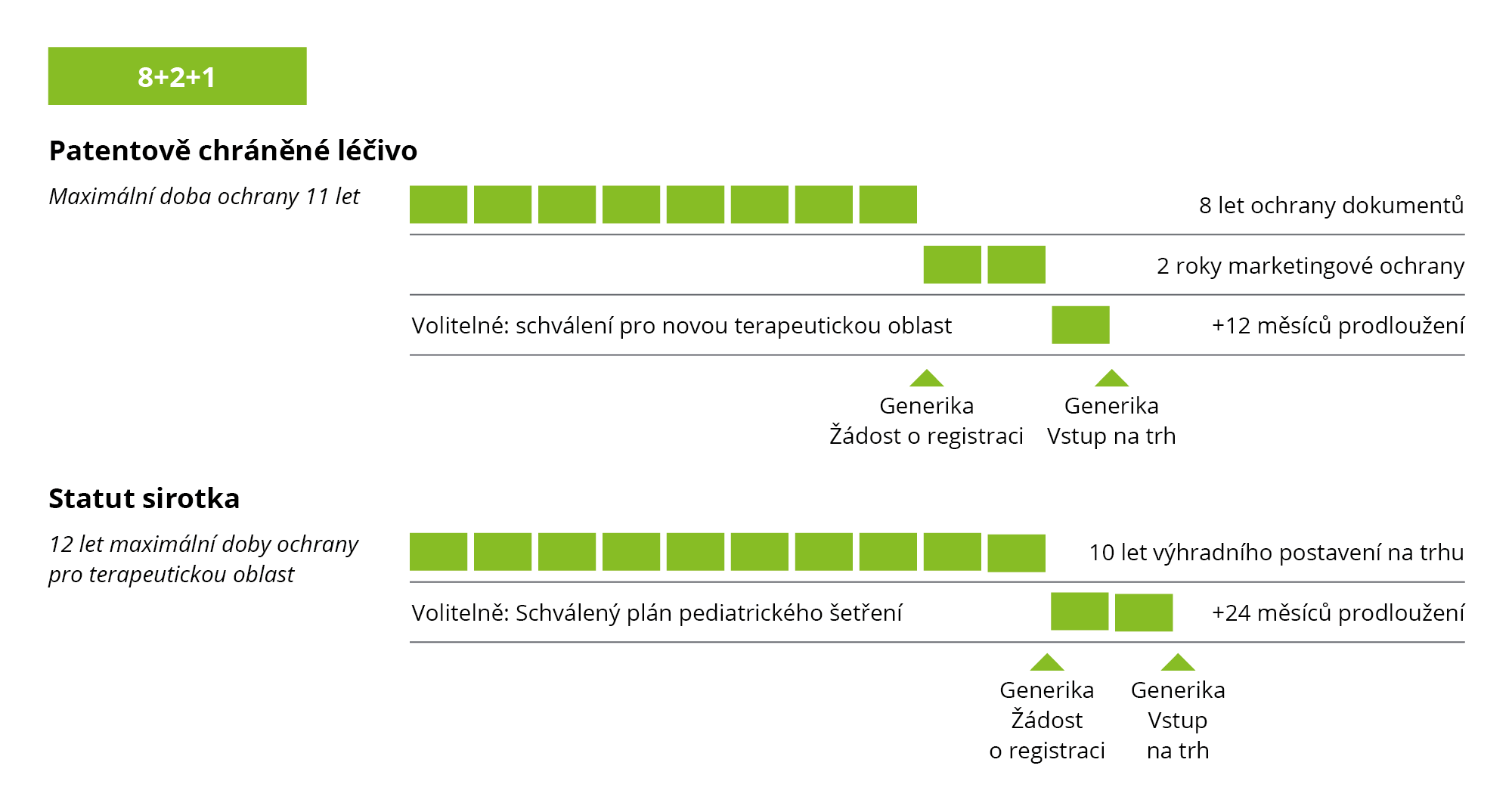
„Pravidlo 8+2+1“
Předchozí úprava stanovila, že patentově chráněné inovativní léčivé přípravky mají osmiletou dokumentační ochranu. Během této doby nesmějí jiné společnosti použít údaje tohoto výrobce pro jinou žádost o registraci, např. pro generika, hybridy nebo biologicky podobné přípravky. Po osmi letech ochrany údajů následuje ochrana při uvádění na trh. Ta obvykle trvá dva roky (max. 10 let od registrace) a brání uvedení generik, hybridů nebo biologicky podobných léčivých přípravků na trh. Jednorázové prodloužení o jeden rok je možné, pokud byl léčivý přípravek registrován pro novou indikaci.
Obrázek 3: Současná úprava ochranné lhůty v Evropě (na základě čl. 14 odst. 11; (ES) č. 726/2004)
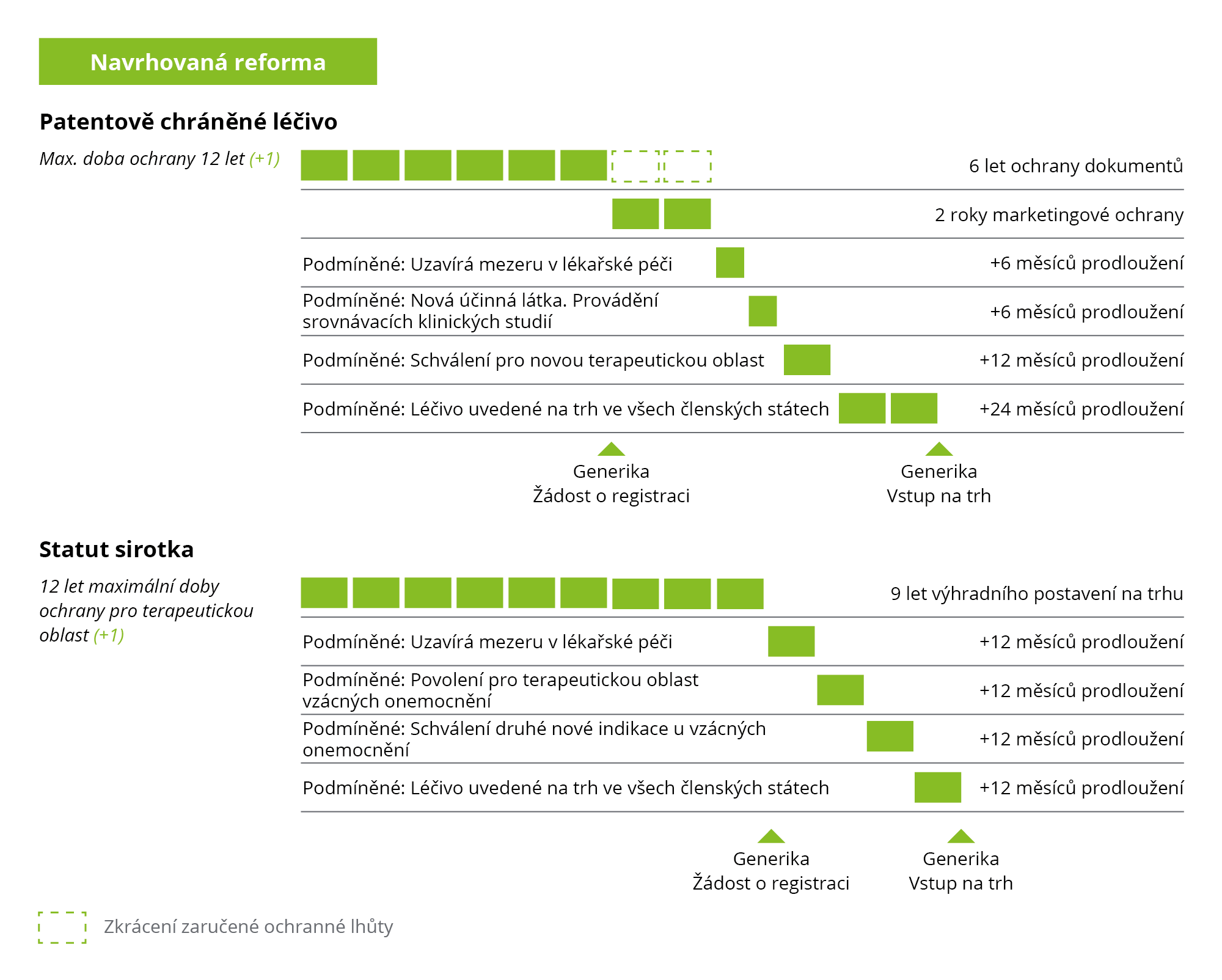
V novém nařízení, které je nyní navrhováno, je ochranná lhůta záměrně instrumentalizována tak, aby motivovala jednotlivé cíle reformy farmaceutického odvětví v oblasti veřejného zdraví prostřednictvím podmíněného prodloužení ochranné lhůty:
„[…]přechod od systému paušálních pobídek pro farmaceutické společnosti k diferencovanému systému pobídek, který odměňuje společnosti za plnění důležitých cílů v oblasti veřejného zdraví, jako je rovný přístup k léčivům ve všech členských státech, vývoj léčiv, která vyplňují mezery ve zdravotní péči, provádění srovnávacích klinických studií a vývoj léčiv, která mohou léčit i jiné nemoci. Pro léčivé přípravky pro vzácná onemocnění se navrhuje podobná diferenciace, pokud jde o exkluzivitu na trhu.“
Obrázek 4: Navrhovaná reforma ochranné lhůty v Evropě
Důležité: Navrhovaná reforma nemá vliv na systém ochrany duševního vlastnictví v EU (patenty, ochranné známky, autorská práva, dodatková ochranná osvědčení).
Různé názory na navrhovanou úpravu ochranné lhůty
Evropská komise ve svém legislativním návrhu prodloužila maximální dobu ochrany o 1 rok pro běžné i vzácné léčivé přípravky, což interpretuje v kontextu některých dalších navrhovaných opatření (např. kratší doba zpracování v EMA, dřívější a lepší poradenství EMA, přenosné vouchery na ochranu dokumentace pro „revoluční“ antimikrobiální přípravky) jako pozitivní krok pro farmaceutický průmysl:
„Tato opatření představují atraktivní a mezinárodně konkurenceschopnou právní ochranu, která doplňuje stávající systém práv duševního vlastnictví a poskytuje společnostem další pobídku k inovacím.“
První vyjádření a připomínky farmaceutického průmyslu k navrhovaným opatřením vyznívají méně pozitivně. Zejména zkrácení zaručené doby ochrany (o 2 roky u běžných léčivých přípravků, o 1 rok u léčivých přípravků pro vzácná onemocnění) je vnímáno spíše kriticky:
„Farmaceutická legislativa EU hrozí sabotáží evropského odvětví farmaceutického průmyslu, což evropské pacienty ještě více vzdálí od špičkové zdravotní péče.“
(Nathalie Mollová, generální ředitelka, EFPIA)
„Zmírnění ochrany dokumentace, a tedy snížení současného stavu však nepovede k tomu, že by společnosti poháněly výzkum a vývoj léčivých přípravků v EU.“
(Dr. Hans-Georg Feldmeier, předseda představenstva, BPI)
„V kontinentální Evropě se vytváří regulační vzorec, který se vyznačuje především jednou věcí: složitostí! Viděli jsme to loni u německé legislativy v oblasti zdravotnictví (GKV-FinStG) a nyní to vidíme znovu u farmaceutického balíčku opatření EU. Evropa se tak stále více odpojuje od mezinárodního vývoje, a navíc si dovoluje luxus nevysílat žádné signály, že je příznivým místem pro inovace. To bohužel není pro průmysl, který má globální pozici, vůbec dobré.“
(Han Steutel, prezident, VfA)
Jaké argumenty přispívají k tomuto odlišnému vnímání? Nové nařízení zásadně zvyšuje složitost maximalizace ochranné lhůty, protože prodloužení má být vázáno na určité podmínky.
Dvě klíčové otázky týkající se splnění těchto podmínek jsou následující:
- Jak vysoké je dodatečné úsilí a investice v porovnání s potenciálními dodatečnými příjmy z prodloužení ochranné lhůty?
- Má farmaceutická společnost potřebnou kontrolu, aby splnila podmínku prodloužení ochranné lhůty?
Typickým scénářem pro první otázku by bylo například úsilí a náklady na případné další srovnávací studie, které mohou být nezbytné. To zahrnuje jednak náklady na samotnou studii, jednak například otázku, zda je stávající organizace (personál, rozpočet, struktura) vůbec schopna provést řadu dodatečných studií.
Typickým scénářem pro otázku č. 2 je například vstup na trh ve všech členských zemích do 24 měsíců od prvního schválení. Je nesporné, že existují značné rozdíly, pokud jde o délku doby před vstupem na trh. Podle nedávné analýzy EFPAI založené na údajích společnosti IQVIA trvá v EU období od schválení nového léku do jeho dostupnosti pacientům v průměru 511 dní. V Německu je tato doba nejkratší – 133 dní, zatímco v Rumunsku je nejdelší – 899 dní. K těmto rozdílům na vnitrostátní úrovni přispívá několik faktorů, např.:
- délka vyjednávání o ceně;
- délka trvání analýzy nákladů a přínosů;
- poskytování rozpočtů ve zdravotnickém systému na financování;
- zajištění vyúčtování mezi poskytovateli a plátci (pacient, zdravotní pojišťovna, stát).
V mnoha případech nemá farmaceutická společnost kontrolu nad délkou procesu, ale je závislá na místních regulačních orgánech, sdruženích a institucích. Zde je v dalším parlamentním procesu ještě třeba vyjasnit odpovědnost a případné důsledky s ohledem na podmíněné prodloužení ochranné lhůty.
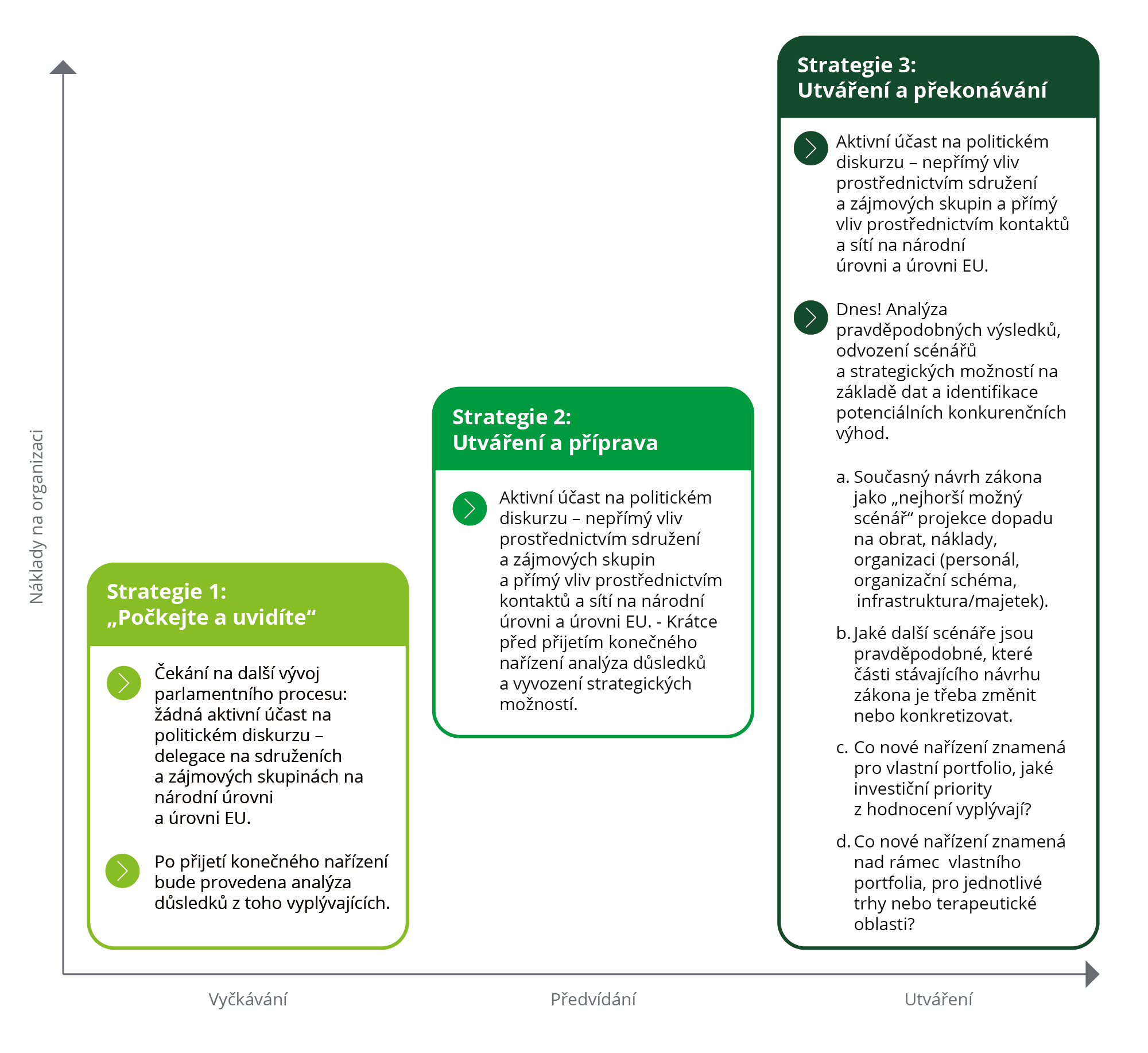
Podněty pro strategické hodnocení navrhované reformy
Současný návrh zákona bude v dalším parlamentním procesu jistě částečně změněn nebo doplněn. Doufat, že základní principy navrhované reformy budou podstatně změněny či vypuštěny, se jeví jako riskantní sázka. Naopak lze předpokládat, že základní princip podmíněného prodloužení ochranné lhůty bude zachován, ať už bude konečná podoba jakákoli.
Farmaceutické společnosti mají různé možnosti, jak se s navrhovanou legislativou EU vypořádat. Nemělo by se také zapomínat, že úspěšná implementace podmíněného prodloužení ochranné lhůty vyžaduje nezanedbatelný čas na přípravu:
- Je současná organizace schopna uvést přípravek na trh v celé EU během 24 měsíců?
- Co nový požadavek znamená pro plánování výroby a dodavatelský řetězec, případně zřízení nebo rozšíření výrobních kapacit, skladů a distribučních center?
- Jaké návrhy studií a další studie budou v budoucnu zapotřebí k získání příslušných podmíněných rozšíření a je na ně současná organizace připravena?
Obrázek 5: Strategické možnosti pro farmaceutické společnosti
Farmaceutické společnosti, které se těmito a podobnými otázkami zabývají velmi brzy (a na základě dat!), se s větší pravděpodobností úspěšně přizpůsobí novým rámcovým podmínkám bez větších problémů ve své provozní činnosti.
Zpočátku to vyžaduje větší organizační úsilí, ale v důsledku toho mohou společnosti jednající formativním způsobem získat konkurenční výhody a větší jistotu při plánování.
Zdroje použité v článku:
Evropská komise: Často kladené otázky: Reforma farmaceutické legislativy; přístup 25. 5. 2023.
Financial times: EU usiluje o vytvoření „jednotného trhu s léčivy“ díky revizi farmaceutických pravidel; navštíveno 25. 5. 2023.
Evropská komise: „Farmaceutická strategie pro Evropu“ (KOM(2020) 761 v konečném znění) 25. 22. 2020; přístup 25. 5. 2023.
Evropská komise: Evropská zdravotnická unie – Společná ochrana našeho zdraví; navštíveno 25. 3. 2023.
Evropská komise: Reforma farmaceutických právních předpisů EU; přístup 25. 3. 2023.
Evropská komise: Často kladené otázky: Reforma farmaceutické legislativy; navštíveno 25. 3. 2023.
Evropská komise: Často kladené otázky: Reforma farmaceutické legislativy; navštíveno 25. 5. 2023.
Evropská federace farmaceutického průmyslu a asociací: Farmaceutická legislativa EU hrozí sabotáží evropského odvětví vědy o živé přírodě, čímž se evropští pacienti vzdalují špičkové zdravotní péči; navštíveno 25. 5. 2023.
ÄrzteZeitung: Farmaceutická reforma EU: Nové pobídky pro inovativní léky; přístup 25. 5. 2023.
Healthpolicy-online: Spolky kritizují „farmaceutický balíček“; přístup 25 . 5. 2023.
Evropská federace farmaceutického průmyslu a asociací: EFPIA Patients W.A.I.T. Indicator 2022 Survey; přístup 25. 5. 2023.
Článek je přeložen z německého originálu Unterlagenschutz für Arzneimittel in Europa – Strategische Optionen für pharmazeutische Unternehmen, publikovaného na webu Deloitte Deutschland.